近日,黄博士团队在国际肝脏病学权威期刊Hepatology(IF=17.4)在线发表最新研究成果:“FGF4 protects the liver from non-alcoholic fatty liver disease by activating the AMPK-Caspase 6 signal axis”,该研究发现FGF4是一种肝脏内源性保护因子及非酒精性脂肪肝疾病(NAFLD/NASH)的新型生物标记物,并证明重组FGF4蛋白可显著遏制代谢性肝脏炎症进展及NASH相关肝纤维化的病理进展,为日益严峻的NAFLD/NASH提供了一种全新的诊疗分子和药物干预策略。这是继科研团队新近报道FGF4作用于骨骼肌发挥血糖调控作用后(Nat Commun, 2021; 12:51258),针对FGF4生物学功能的又一重要新发现。

非酒精性脂肪性肝病(Nonalcoholic fatty liver disease, NAFLD)是指排除酒精和其他明确的损肝因素,以弥漫性肝细胞大泡性脂肪变为主要病理表现,可影响全身多系统的遗传—代谢—病理临床综合征,其疾病发展谱极为广泛,囊括最初的可逆转的肝脂肪变性和非酒精性脂肪肝炎(Non-alcoholic fatty liver disease, NASH),以及后期不可逆的纤维化、肝硬化乃至最终的肝细胞癌(Hepatocellular carcinoma, HCC)。
随着肥胖和代谢综合征的流行,NAFLD已成为全球重大公共健康问题。近十年来,我国NAFLD的患病率大幅增长,高达20%以上,已取代慢性病毒性肝病跃居慢性肝病之首。但目前针对NAFLD/NASH的临床治疗手段和药物非常匮乏,亟需探明新的治疗靶点,研发新的治疗药物。
成纤维细胞因子多肽(fibroblast growth factors, FGFs)是哺乳动物体内分布极为广泛的一类重要细胞因子,包括18个成员,它们以旁分泌或内分泌方式介导发育、组织内稳态/修复和机体代谢中许多关键事件。近年来,研究发现FGFs家族多个成员参与维持肝脏组织细胞和代谢的稳态。
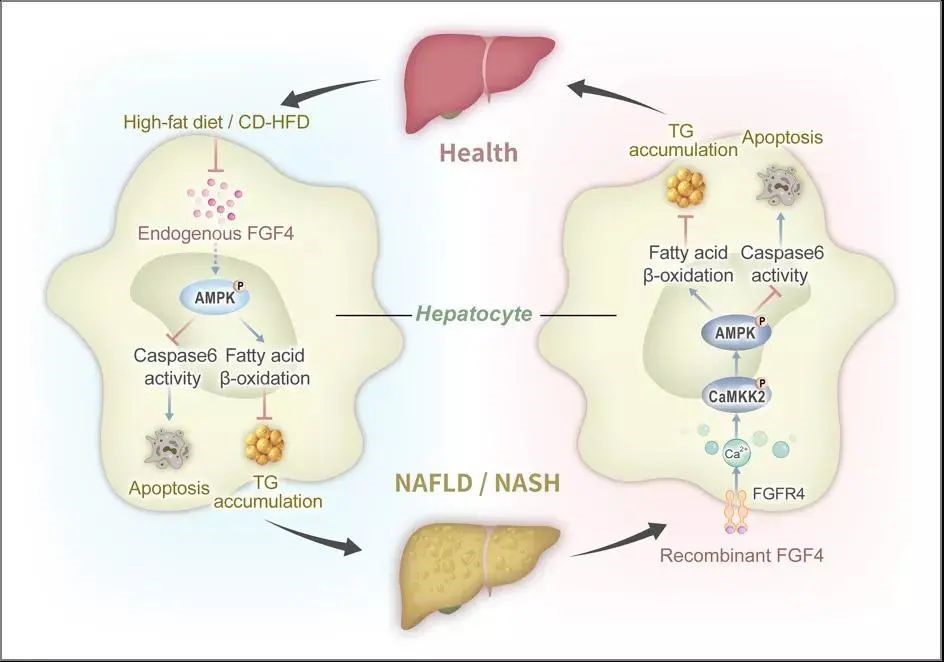
为探索FGFs是否在NAFLD/NASH进展中发挥调控作用,本研究首先通过大样本临床分析,发现肝实质细胞特异表达的FGF4是FGFs家族成员中唯一的NAFLD/NASH负性响应因子,与脂肪肝病人的病程进展呈现显著的负相关;进一步,通过构建肝脏实质细胞特异性敲除Fgf4的转基因老鼠,发现Fgf4的缺失会显著加重高脂饮食(High-fat diet,HFD)引起的肝脏脂肪变性和损伤,提示FGF4可作为肝脏内源性保护因子及疾病的新型生物标记物。
本研究还构建了HFD诱导的NAFLD和胆碱缺乏的HFD(choline-deficient HFD, CD-HFD)诱导的NASH小鼠模型,发现外源重组rFGF4能够显著减轻NAFLD/NASH小鼠肝脏脂肪变性、炎症、肝脏损伤和纤维化,从而达到改善甚至逆转NAFLD/NASH的作用。机制研究证实:FGF4可通过激活肝细胞特异性受体FGFR4而促进钙离子内流,进而激活CaMKK2-AMPK-Caspas6通路,抑制肝细胞凋亡、改善肝脏脂质堆积,显著遏制炎症进展。重要的是,与单纯AMPK激动剂相比,rFGF4治疗不会引起心肌肥大等副作用;而且与已有报道的肝脏代谢调控因子FGF19不同,rFGF4长期给药并不会引起肝脏组织中肿瘤相关信号STAT3的激活和肿瘤病变的发生,具有更好的药物安全性。总之,本研究从病理、生理和药理三个维度阐释了FGF4是NAFLD/NASH的全新潜在治疗靶点和候选药物分子。
近年来,黄博士课题组紧紧围绕生长因子信号与代谢调控开展了系统性创新研究:
1)从受体活化变构、受体-底物识别模式及胞内分子级联元件层面,证明受体二聚化是FGF激活下游信号的关键因素(Mol Cell, 2016);从受体感知配体信号的维度,诠释了受体二聚化在增殖、代谢转换之间的“开关”功能与意义,提出并验证了FGF受体二聚化“阈值调控模型(threshold regulatory model)”(PNAS, 2020; Cell Rep, 2017);
2)基于FGF受体二聚化调控模式,发现旁分泌FGF4调控糖脂代谢新功能(Nat Commun, 2021),特别是,发现不同代谢组织中特定FGFR介导的CaMKK2-AMPK通路在旁分泌FGFs抗糖尿病及其并发症中的关键调控地位,验证了相关信号及关键节点分子作为糖尿病及其并发症的潜在靶标功效(Hepatology, 2022, 2021;Signal Transduct Target Ther, 2021;Kidney Int, 2018)。本工作是系列研究的延续和补充,丰富了FGF生物学功能、药理作用的理论体系,并付诸代谢性疾病新药研发实践。相关工作得到了国家自然基金委,国家科技部重点研发计划的支持。
论文链接:https://aasldpubs.onlinelibrary.wiley.com/doi/abs/10.1002/hep.32404